本次研究成果的发表,不仅丰富了学界对该亚型室管膜瘤的理解,也为基于dna甲基化的中枢神经系统肿瘤分类检测方法的应用,提供了坚实的研究数据支持。

论文发布截图
研究背景
室管膜瘤(epn)是一类具有异质性的中枢神经系统肿瘤,依据解剖位置(如幕上、后颅窝和脊髓)以及分子特征,可分为至少10个亚型。幕上室管膜瘤(st-epns)的主要特征是存在两种类型的融合变异,涉及锌指易位相关基因zfta和yes1相关转录调节因子yap1。其中,zfta融合出现在约66-84%的儿科幕上室管膜瘤病例中,通常表明预后不良,而yap1融合相对罕见,仅占儿科病例的6-7%,通常表现出更为惰性的生物行为。
近期研究发现,zfta或yap1融合的室管膜瘤也可以在后颅窝(pf)或脊髓(sp)中出现。本文报道了两例非幕上yap1融合室管膜瘤(分别位于小脑和脊髓),并进行了全面的组织病理学和分子特征及预后分析,以提供对这些罕见病例的详细见解。
研究内容
病例1
男性,18个月,走路不稳一个月,呕吐4天。颅磁共振成像(mri)显示小脑占位性病变,增强后出现不均匀强化,组织病理学显示为室管膜瘤,有细胞密度增加、核分裂象增多、微血管增生及坏死,并伴有间质分化(who 3级)。
病例2
女性,51岁,20年前无明显诱因出现右侧肋骨以下平面痛温觉消失,无明显左侧躯体及肢体感觉或活动障碍,自行中医及物理治疗,症状有所好转。一年半前出现了双下肢乏力、伴双下肢肿胀。mri显示c7至t1段髓内占位性病变,组织病理学检查显示为室管膜瘤形态(who 2级),细胞密度中等,部分细胞胞浆嗜酸性及部分细胞胞浆颗粒状,伴血管管壁显著的玻璃样变性。
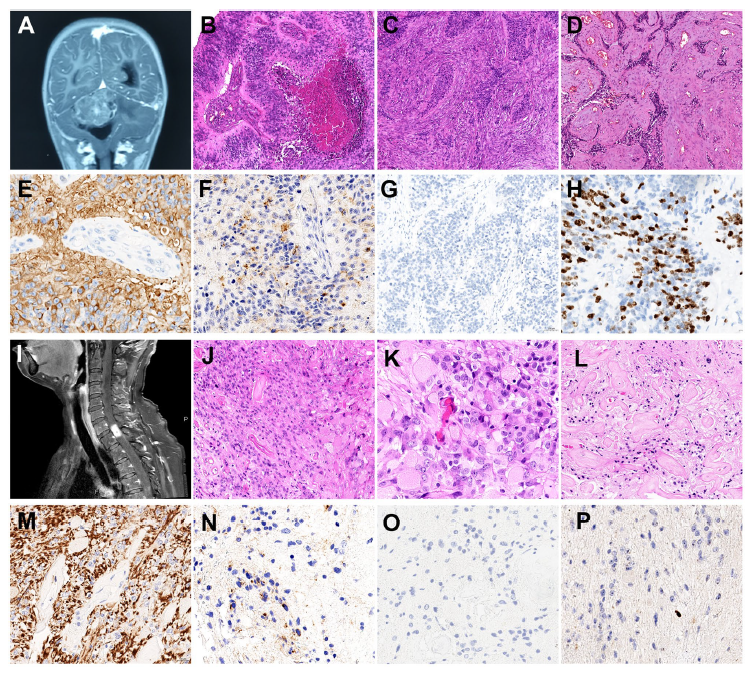
图1:a-h为病例1的组织病理学检查;
图i-p为病例2的组织病理学检查
rna测序显示病例1具有yap1-maml2融合,而病例2具有yap1-fam118b融合,两例yap1重排也通过荧光原位杂交(fish)验证。
此外,基于机器学习模型,使用epic v2.0 935k芯片数据进行dna甲基化脑肿瘤聚类分析,病例1聚类于yap1阳性的室管膜瘤(校准评分:0.99),病例2聚类于脊髓室管膜瘤(校准评分:0.45),同时检查也除外了原发性幕上肿瘤转移到幕下或脊髓的可能。
因此,对于病例1,结合病理学检查,医生最终诊断为pf-epn-yap1-maml2融合阳性,who 3级,大体全切除后进行局灶放射治疗。然而,患者肿瘤在4个月后局部复发。最终诊断病例2为sp-epn-yap1-fam118b融合阳性,who 2级,大体全切除无辅助治疗,患者在6个月的随访中无复发。
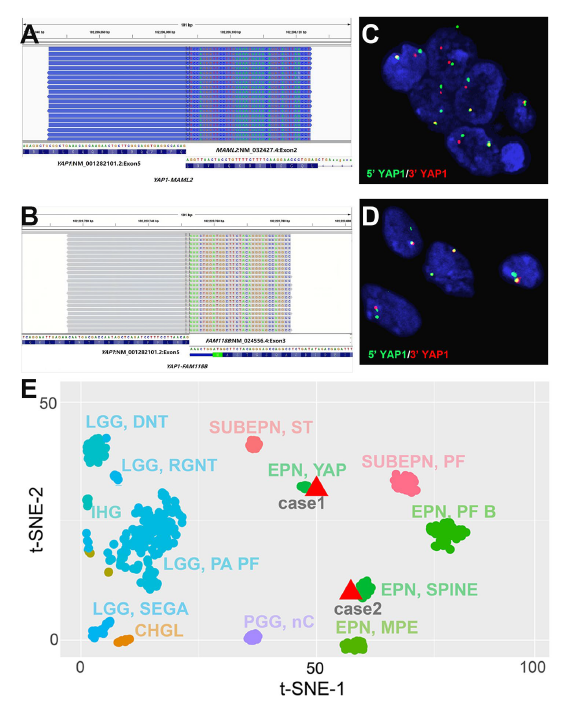
图2:两病例融合型验证及dna甲基化机器学习聚类
研究结果
作为一种罕见的分子亚型,yap1融合室管膜瘤通常表明预后较好,普遍发生在幕上区域,并且主要影响女性(男女比为2.75),特别是2岁以下儿童(中位年龄为1.4岁)。尽管已有yap1融合的后颅窝和脊髓室管膜瘤的报道,但尚不清楚它们是否代表室管膜瘤的一个独特亚群,还是与yap1融合的幕上室管膜瘤密切相关。
另外,yap1基因编码hippo抑癌基因通路的下游效应子yap1蛋白,其通过转录增强关联结构域(tead)调节转录。yap1融合伴侣包括 mamld1、fam118b、maml2、tfe3、ss18和zfta。其中,yap1-mamld1是yap1融合幕上室管膜瘤中最常见的融合,而yap1-maml2和yap1-fam118b融合极为罕见。
基于上述结果,本研究提出yap1融合的幕下室管膜瘤的病理特征和预后与yap1融合的幕上室管膜瘤并不完全相同,yap1融合在不同解剖部位室管膜瘤的发生和发展过程中的生物学功能有待进一步研究。
鉴于脑肿瘤的高度异质性,第五版《世界卫生组织(who)中枢神经系统肿瘤分类指南》将基因、分子及信号通路改变等特征纳入分类系统,结合病理组织学特征、免疫组化等方法构建综合诊断框架,并特别突出了基于dna甲基化谱分类的重要性。对于明确一些具有少见形态学特征的肿瘤,dna甲基化谱可能是非常有效的方法,有时甚至是确定一些罕见肿瘤类型和亚型的唯一方法,因而成为中枢神经系统肿瘤分类不可或缺的依据。
迪安诊断基于dna甲基化的中枢神经系统肿瘤分类检测,依托illumina epic v2.0甲基化芯片技术,覆盖人体全基因组范围内约935,000个cpg岛的甲基化水平监测,借助精密设计的机器学习算法,能精准区分多达91种脑肿瘤的分型,并同步解析脑胶质瘤的癌基因甲基化模式(cimp)与o6-甲基鸟嘌呤dna甲基转移酶(o6-methylguanine dna methyltranferase,mgmt)启动子甲基化状态,进而为临床治疗规划与生存预估提供决策辅助。



